-- 論臨床試驗設計的重要性
近日,藥渡發布了題為《Challenge the best-中國Biotech走向國際,系列報道(二)-- 論臨床試驗設計的重要性 》的文章,原文內容如下:
在當前國內創新藥研發追趕國際領先水平的過程中,臨床試驗已成為決定成敗的關鍵。近日康乃德生物醫藥有限公司宣布CBP-307治療中重度潰瘍性結腸炎2期臨床試驗的12周頂線結果,在臨床緩解率(FDA和CDE均認可的藥物審批指標)和其他次要終點方面達到了統計學意義,并且顯示出有效下調淋巴細胞數的藥理活性,且CBP-307總體上顯示出良好的耐受性。但主要療效終點-試驗組與基線相比“改良Mayo評分”的改善幅度未達到統計學意義。藥渡參考同類藥物研發進展和國外主流投行的評論,更為深入和客觀地對其結果進行了解讀。
前言
潰瘍性結腸炎(UC)是一種累及結腸黏膜和黏膜下層的連續性、倒灌性、非特異性的慢性腸道炎性疾病,臨床表現為持續或反復發作的腹瀉、黏液膿血便伴腹痛和不同程度的全身癥狀,病程多在4~6周以上,可大大降低個人的生活質量。UC復發率高,臨床表現變異性大,有統計稱近50%患者需要住院治療。據估算全球UC藥物市場已超過75億美元,占免疫市場總量的10%,預計到2026年UC藥物市場將達到110-120億美元。
近年來我國UC報告病例明顯增加,正逐漸成為常見的腸道疾病和慢性腹瀉的主要病因,預計我國UC患病率會逐步接近西方國家(>40/10萬人)。UC病因尚不明確,暫無法治愈,國內以氨基水楊酸類和類固醇激素類藥物治療為主,免疫抑制劑應用較少。
鑒于顯著的未滿足臨床需求,國內外都在積極探索多種靶向治療方法,主要的靶點和機制包括:選擇性S1P受體調節劑、Janus激酶(JAK)3抑制劑、人白細胞介素(IL)-12,IL-22,IL-23和IL-36抑制劑及二氫乳清酸脫氫酶(DHODH)抑制劑等。其中BMS(原Receptors公司)的選擇性S1P受體調節劑Ozanimod于2020年被FDA和EMA批準上市,輝瑞(原Arena Pharmaceuticals公司)的Etrasimod不久前剛完成一項臨床3期研究,兩者相關的收購交易金額均超過60億美元,印證了這類藥物的巨大潛力。
在UC治療藥物的臨床研究中,基于改良Mayo評分(評估大便頻率、直腸出血和內窺鏡檢查評分)和完整Mayo評分(在改良Mayo評分基礎上加入醫生整體評估)的臨床緩解率,是FDA和CDE認可的注冊審批主要療效終點,也是支持早前獲批治療UC藥物的臨床試驗中的主要療效終點。
CBP-307臨床結果解讀
CBP-307是康乃德基于自主專有的免疫調節技術發現的小分子口服1-磷酸鞘氨醇受體1(S1P1)調節劑,作用機制如下圖:
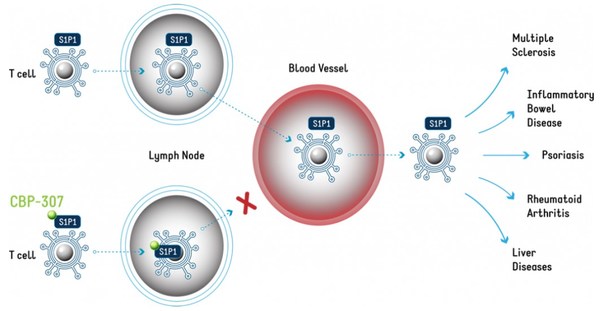
來源:康乃德官網
S1P1介導T細胞從淋巴結遷出進入外周血液循環,從而活性T細胞可遷移到組織中釋放炎癥介質。CBP-307 誘導 T 細胞表面的S1P1內化,將 T 細胞困在淋巴結內,阻止其遷移到炎癥部位,從而達到減輕炎癥的目的。
CBP-307CN002是一項進行中的2期研究,旨在評估CBP-307作為誘導和維持治療中重度成年UC患者的有效性和安全性。這項隨機、雙盲、安慰劑對照、多中心研究共入組了145例受試者,研究有兩個劑量活性藥物組(CBP-307 0.1 mg [n=39];CBP-307 0.2 mg [n=53])和一個安慰劑組(n=53),受試者來自4個國家的60多個研究中心。目前還在繼續2期UC試驗維持治療和安全性隨訪,本次發布的是第一階段12周頂線結果,藥渡的解讀如下:
CBP-307臨床結果積極,臨床緩解率(FDA及CDE批準上市的關鍵指標)已達到預期
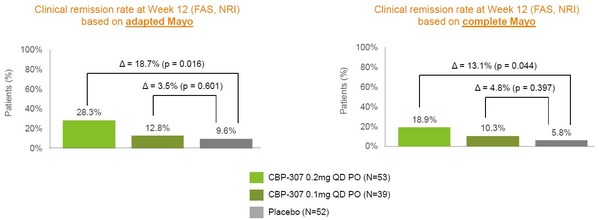
來源:康乃德官網
由上圖可見,在基于改良和完整Mayo評分兩方面,0.2mg CBP-307組與安慰劑組相比都達到了更高的臨床緩解率,且具有統計學意義。若能在3期研究中延續這一趨勢,足以達到上市審批的要求。
至于容易引起爭議的主要療效終點-改良Mayo評分較基線的最小二乘(LS)均值變化,確實未達到統計學意義,詳見下圖(左側),但如果基于完整Mayo評分(右側),則具有顯著的統計學差異。
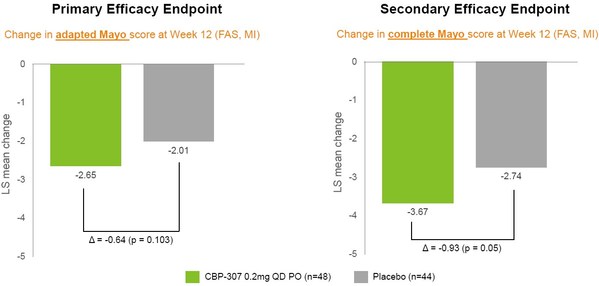
來源:康乃德官網
藥渡注意到該研究安慰劑組的評分變化幅度較大(-2.01和-2.74),大于同類主要競品Etrasimod在相關臨床研究中的數值(-1.5和-2.08),這對結果統計造成了一定的影響。
據不完全統計,在我國中度UC患者比例超過40%,重度患者約20%。對于創新的口服S1P1調節劑,出于謹慎的考慮,國內臨床試驗執行過程中往往傾向于納入中度的患者而非重度,可能存在一定的選擇偏倚,造成基線變化幅度較大;后續研究中如果能夠增加入組患者數,或者增加重度患者的比例,可能會得到更顯著的療效差異。
另外,Ozanimod和Etrasimod的相關臨床試驗中,入組患者的平均患病年限更長(>6年),在Mayo評分上可能更高,從而具有基線差異,因此臨床試驗中的評分下降幅度可能相較于CBP-307更多。
本次試驗人群中亞洲人占比較高(0.2mg CBP-307組為48/53,90.6%),參考以往其它競品所開展的研究,歐美和亞裔UC患者的臨床數據是有差異的:維多珠單抗的3期研究中,日本患者安慰劑組的臨床緩解和應答顯著高于全球患者,導致日本受試者給藥組的數據表現不如全球患者;英夫利昔單抗的3期研究中,中國患者的疾病年限相較全球要短1-2年,安慰劑組方面中國受試者的應答率等也較全球更高。因此藥渡推測未來如果納入更多歐美患者有望得到更好的統計學數據。
Fierce Biotech、Bioworld、Jefferies和SVB Leerink等國外專業機構均認可本次披露的臨床結果展示出了CBP-307能夠帶來較好的臨床獲益,Jefferies還指出本次試驗獲得的緩解率若經安慰劑校正可能好于同靶點的其它競品。另外,國內外相關知名IBD臨床研究PI也基本認可CBP-307目前顯示出的有效性和安全性。盡管臨床2期primary endpoint的選擇對結果的解讀造成了一些影響,但應該不會被要求重新進行臨床試驗,預計未來繼續推進3期臨床研究也不會有問題(業界不乏曾經遇到階段性臨床結果與首要終點預期不符,但通過優化后續關鍵性臨床試驗設計最終順利獲批的例子,如吉非替尼、納武利尤單抗等)。
Piper Sandler在上個月曾專門發文回顧了CBP-307臨床前和臨床I期的數據,CBP-307對S1P1的活性(EC50)最強(與主要競品相比),對S1P4和S1P5的效力明顯低于S1P1,對S1P3(已知有安全問題的受體亞型)基本沒有活性。更低的劑量下即可實現較強的淋巴細胞計數抑制,且停藥后淋巴細胞恢復更快(<7d),與同類產品所公開的數據相比,CBP-307明顯縮短了治療停藥后免疫力恢復的時間,從而可降低患者感染的風險。
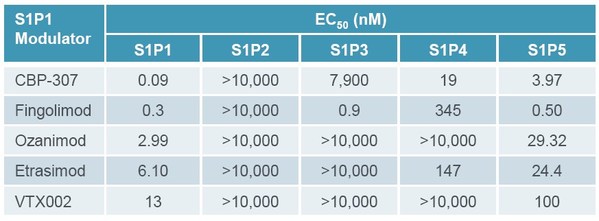
來源:Piper Sandler
以上這些優點給予開發者足夠的信心,開發者也有理由相信,通過優化臨床試驗設計,并進一步提高患者入組質量,CBP-307未來有望獲得更優的臨床結果。
中國Biotech挑戰國際一線的必經之路
中國創新藥研發的整體水平尚未進入國際第二梯隊,以往看到許多項目處于兩個"10"的狀態:據不完全統計,以中位數據計算,2019-2020年中國上市1類新藥距全球First-in-class產品上市滯后10年;同靶點產品上市時間次序也僅保住前10,整體研發進度的落后意味著進入臨床研究階段可參考的信息和經驗較多。而對于當前緊跟國際一線的企業來說,往往信息資源和可參考經驗十分有限,想要做出最適合具體項目的臨床試驗設計無疑會面臨很多的困難,會有更多探索的成分,自然無法保證做出的選擇總是合適的。故此,新藥創新國際化也是一條"歷盡風雨、方現彩虹"的道路。挑戰者必須在實戰中勇于創新,持續學習并及時調整和提高,獲得突破繼而最終才能成功。
因此藥渡認為至少需要從三個方面進行加強:1、強化信息資源的獲取和決策參考;2、大幅度提高臨床研究相關的人才和資源投入,對可能出現的各種情況提前做好預案;3、善用國內開展臨床研究的便利條件(成本控制、專家資源、政策扶持等),多方合力為項目保駕護航。
藥渡集團依托自有的研發大數據、豐富的咨詢項目經驗和外部專家資源,愿為中國Biotech助一臂之力。
結語
以康乃德為代表的Leading biotech在自免疾病藥物創新趕超國際領先水平方面做出了積極的努力,未來康乃德將會積極尋求合作者一同拓展海內外臨床研究,惠及更多國家的患者,和百濟神州、信達、君實、天境生物等企業并肩成為進軍國際市場的積極探路者。在國際形勢復雜多變的背景下,更需要國內研發、投資、審評等各方人士的理解和支持。涉及創新的靶點和復雜的疾病,在臨床開發過程中不斷完善和優化會成為常態。尚在進行中的2期研究"missed primary endpoint"并不會掩蓋其它指標方面的積極結果,而是提示了后續優化臨床試驗設計的方向。CBP-307是S1P1靶點的全球TOP3產品,在藥學特性、藥效和安全性上的優勢提示可能有best in class的潛質,或至少與國際一線新藥相當,有希望為中國創新藥研發真正跨入國際第二梯隊添磚加瓦。
(新媒體責編:pl0902)
聲明:
1、凡本網注明“人民交通雜志”/人民交通網,所有自采新聞(含圖片),如需授權轉載應在授權范圍內使用,并注明來源。
2、部分內容轉自其他媒體,轉載目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責。
3、如因作品內容、版權和其他問題需要同本網聯系的,請在30日內進行。電話:010-67683008
人民交通24小時值班手機:17801261553 商務合作:010-67683008轉602 E-mail:[email protected]
Copyright 人民交通雜志 All Rights Reserved 版權所有 復制必究 百度統計 地址:北京市豐臺區南三環東路6號A座四層
增值電信業務經營許可證號:京B2-20201704 本刊法律顧問:北京京師(蘭州)律師事務所 李大偉
 京公網安備 11010602130064號 京ICP備18014261號-2 廣播電視節目制作經營許可證:(京)字第16597號
京公網安備 11010602130064號 京ICP備18014261號-2 廣播電視節目制作經營許可證:(京)字第16597號



